Διπλή Αντιαιμοπεταλιακή Αγωγή (DAPT) – Plavix & Ασπιρίνη μετά από Stent και Έμφραγμα
Τελευταία ενημέρωση:
Η διπλή αντιαιμοπεταλιακή αγωγή (DAPT) με
Plavix και ασπιρίνη
μειώνει δραστικά τον κίνδυνο
θρόμβωσης stent, εμφράγματος και εγκεφαλικού
μετά από οξύ στεφανιαίο σύνδρομο, stent ή έμφραγμα.
Η σωστή διάρκεια, δοσολογία και γαστροπροστασία
είναι κρίσιμες για μέγιστη ασφάλεια.
1
Τι είναι η διπλή αντιαιμοπεταλιακή αγωγή (DAPT)
Η διπλή αντιαιμοπεταλιακή αγωγή (DAPT) είναι η ταυτόχρονη χορήγηση
δύο φαρμάκων που αναστέλλουν τα αιμοπετάλια — συνήθως
ασπιρίνη (ASA) και Plavix (κλοπιδογρέλη).
Σκοπός της είναι να
αποτρέψει τον σχηματισμό θρόμβων
μέσα στις στεφανιαίες αρτηρίες και στα stents.
Σε απλά λόγια, η DAPT κρατά το αίμα
«λιγότερο κολλώδες»
στα σημεία όπου υπάρχει
μέταλλο (stent)
ή φρέσκια αγγειακή βλάβη,
μειώνοντας τον κίνδυνο
εμφράγματος, εγκεφαλικού και αιφνίδιου καρδιακού θανάτου.
Η αγωγή αυτή χρησιμοποιείται
όχι προληπτικά για όλους,
αλλά στοχευμένα σε ασθενείς
με πολύ υψηλό θρομβωτικό κίνδυνο.
2
Γιατί χρειάζεται μετά από stent ή έμφραγμα
Μετά από στεφανιαίο stent ή οξύ έμφραγμα,
το εσωτερικό του αγγείου είναι
τραυματισμένο
και το μέταλλο του stent λειτουργεί ως
ξένο σώμα.
Αυτό ενεργοποιεί έντονα τα αιμοπετάλια
και αυξάνει δραματικά τον κίνδυνο
οξείας θρόμβωσης.
Χωρίς DAPT, ένας θρόμβος μπορεί να
κλείσει αιφνίδια το stent,
προκαλώντας
καταστροφικό έμφραγμα ή αιφνίδιο θάνατο.
Η σωστά εφαρμοσμένη διπλή αγωγή
μειώνει αυτόν τον κίνδυνο κατά
60–70%
τους πρώτους κρίσιμους μήνες,
δηλαδή στο διάστημα που η αρτηρία
είναι πιο «ευάλωτη» στη θρόμβωση.
3
Plavix και ασπιρίνη – πώς λειτουργεί ο συνδυασμός
Ο συνδυασμός Plavix (κλοπιδογρέλη) + ασπιρίνη αποτελεί τον πυρήνα της
διπλής αντιαιμοπεταλιακής αγωγής (DAPT), επειδή στοχεύει
δύο ανεξάρτητους αλλά συμπληρωματικούς μηχανισμούς ενεργοποίησης των αιμοπεταλίων.
Αυτός ο «διπλός αποκλεισμός» είναι ο λόγος που η DAPT προστατεύει
πολύ αποτελεσματικότερα από την απλή μονοθεραπεία.
Τα αιμοπετάλια ενεργοποιούνται όταν έρθουν σε επαφή με
τραυματισμένο αγγειακό τοίχωμα, μέταλλο stent ή αθηρωματική πλάκα.
Τότε εκκρίνουν ουσίες που τα κάνουν να «κολλάνε» μεταξύ τους
και να σχηματίζουν θρόμβο.
Η ασπιρίνη και το Plavix παρεμβαίνουν
σε διαφορετικά σημεία αυτής της αλυσίδας.
Η ασπιρίνη αναστέλλει το ένζυμο COX-1,
εμποδίζοντας τη σύνθεση της θρομβοξάνης Α2,
μιας ουσίας που δίνει το «σήμα ενεργοποίησης» στα αιμοπετάλια.
Χωρίς θρομβοξάνη, τα αιμοπετάλια δεν ενεργοποιούνται εύκολα.
Το Plavix, από την άλλη πλευρά,
μπλοκάρει τους υποδοχείς P2Y12 στην επιφάνεια των αιμοπεταλίων,
οι οποίοι φυσιολογικά ενεργοποιούνται από το ADP.
Αυτός ο μηχανισμός είναι απαραίτητος για να
συσσωρεύονται και να σταθεροποιούνται τα αιμοπετάλια μέσα στον θρόμβο.
Όταν χορηγούνται μαζί:
- Η ασπιρίνη εμποδίζει τα αιμοπετάλια να «ξυπνήσουν»
- Το Plavix εμποδίζει τα αιμοπετάλια να «κολλήσουν» μεταξύ τους
Αυτός ο συνδυασμός δημιουργεί μια
διπλή αντιθρομβωτική ασπίδα
που είναι πολύ πιο αποτελεσματική
από οποιοδήποτε από τα δύο φάρμακα μόνο του.
Γι’ αυτό το σχήμα Plavix + ασπιρίνη θεωρείται
gold standard
μετά από:
- Τοποθέτηση στεφανιαίου stent
- Οξύ έμφραγμα μυοκαρδίου (STEMI ή NSTEMI)
- Ορισμένα ισχαιμικά εγκεφαλικά υψηλού κινδύνου
Χωρίς DAPT, ο κίνδυνος
οξείας θρόμβωσης stent
ή υποτροπής εμφράγματος είναι πολλαπλάσιος
και μπορεί να οδηγήσει σε
αιφνίδιο καρδιακό θάνατο.
Αυτός είναι ο λόγος που η σωστή και συνεχής λήψη
του συνδυασμού θεωρείται
θεραπεία ζωής
κατά τους πρώτους μήνες μετά το συμβάν.
4
Πώς δρουν μαζί στα αιμοπετάλια (COX-1 & P2Y12)
Η ασπιρίνη αναστέλλει το ένζυμο COX-1,
εμποδίζοντας τη σύνθεση της
θρομβοξάνης Α2,
μιας ουσίας που δίνει το «σήμα ενεργοποίησης» στα αιμοπετάλια.
Το Plavix (κλοπιδογρέλη) μπλοκάρει τους υποδοχείς P2Y12,
μέσω των οποίων τα αιμοπετάλια
συσσωρεύονται και σταθεροποιούν τον θρόμβο.
Όταν δίνονται μαζί:
- Η ασπιρίνη μειώνει την έναρξη της ενεργοποίησης.
- Το Plavix εμποδίζει τη συσσωμάτωση και σταθεροποίηση.
Έτσι, τα αιμοπετάλια
ούτε «ξυπνούν» ούτε «κολλάνε» αποτελεσματικά,
παρέχοντας
διπλή αντιθρομβωτική προστασία
πολύ ισχυρότερη από κάθε φάρμακο μόνο του.
5
Πότε χορηγείται DAPT
Η DAPT χορηγείται όταν ο
κίνδυνος θρόμβωσης
υπερτερεί του
κινδύνου αιμορραγίας.
Αυτό συμβαίνει κυρίως μετά από οξέα καρδιαγγειακά συμβάματα και επεμβάσεις.
Οι βασικές ενδείξεις περιλαμβάνουν:
- Μετά από PCI με τοποθέτηση stent (DES ή BMS)
- Μετά από οξύ έμφραγμα μυοκαρδίου (STEMI ή NSTEMI)
- Μετά από ασταθή στηθάγχη
- Σε επιλεγμένους ασθενείς μετά από ισχαιμικό εγκεφαλικό ή TIA
- Σε περιφερική αρτηριακή νόσο (PAD) υψηλού ισχαιμικού κινδύνου
Σε σταθερούς ασθενείς χωρίς πρόσφατο καρδιαγγειακό συμβάν,
η μακροχρόνια DAPT δεν συνιστάται,
καθώς αυξάνει τον αιμορραγικό κίνδυνο
χωρίς αντίστοιχο όφελος στην πρόληψη θρόμβων.
6
Πόσο διαρκεί η διπλή αγωγή
Η διάρκεια της DAPT καθορίζεται από τον τύπο του stent και το είδος του
καρδιαγγειακού συμβάντος.
Στις περισσότερες περιπτώσεις κυμαίνεται από
6 έως 12 μήνες, επειδή αυτό είναι το διάστημα με τον μεγαλύτερο κίνδυνο
θρόμβωσης stent και υποτροπής εμφράγματος.
Μετά την ολοκλήρωση της DAPT,
οι περισσότεροι ασθενείς συνεχίζουν μόνο με
ένα αντιαιμοπεταλιακό (συνήθως ασπιρίνη ή Plavix),
για μακροχρόνια καρδιοπροστασία.Οι σύγχρονες κατευθυντήριες οδηγίες (ESC, AHA) συνιστούν
τουλάχιστον 6–12 μήνες DAPT
σε ασθενείς με stent ή έμφραγμα,
εκτός αν ο αιμορραγικός κίνδυνος είναι υπερβολικά υψηλός.
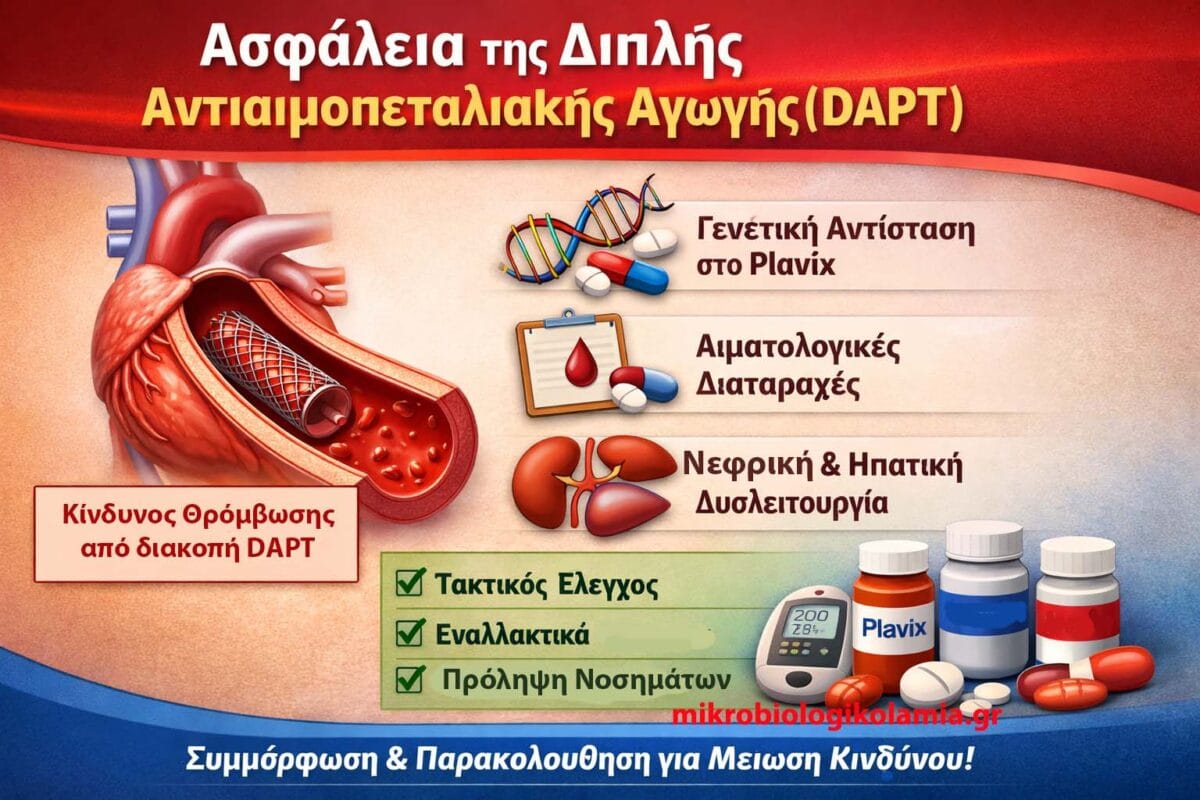
Η αποτελεσματικότητα της διπλής αντιαιμοπεταλιακής αγωγής (DAPT) δεν εξαρτάται μόνο από τη διάρκεια αλλά και από τη συμμόρφωση του ασθενούς. Μελέτες δείχνουν ότι η πρόωρη διακοπή του Plavix ή της ασπιρίνης μέσα στους πρώτους 6 μήνες μετά από stent αυξάνει τον κίνδυνο θρόμβωσης stent έως και 5 φορές. Αυτός είναι ο λόγος που ακόμη και μικρά διαλείμματα λίγων ημερών μπορεί να έχουν σοβαρές συνέπειες.
Επιπλέον, η βιολογική ανταπόκριση στην κλοπιδογρέλη (Plavix) δεν είναι ίδια σε όλους. Ένα ποσοστό ασθενών έχει μειωμένη ενεργοποίηση του φαρμάκου λόγω γενετικών παραγόντων (CYP2C19), κάτι που μπορεί να οδηγήσει σε ανεπαρκή αναστολή αιμοπεταλίων. Σε τέτοιες περιπτώσεις, οι καρδιολόγοι συχνά στρέφονται σε πιο ισχυρά φάρμακα όπως το ticagrelor ή το prasugrel, ιδιαίτερα μετά από οξύ έμφραγμα.
Σημαντικό ρόλο παίζει και το αιματολογικό προφίλ του ασθενούς. Χαμηλή αιμοσφαιρίνη, θρομβοπενία ή διαταραχές πήξης αυξάνουν τον κίνδυνο αιμορραγίας κατά τη διάρκεια της DAPT. Για τον λόγο αυτό, σε ασθενείς που λαμβάνουν Plavix και ασπιρίνη συνιστάται περιοδικός έλεγχος:
- Γενικής αίματος
- Αιμοπεταλίων
- Δεικτών αναιμίας
Ακόμη, η συνύπαρξη νεφρικής νόσου ή ηπατικής δυσλειτουργίας μεταβάλλει τόσο την αποτελεσματικότητα όσο και την ασφάλεια της διπλής αγωγής. Σε αυτές τις ομάδες, οι κατευθυντήριες οδηγίες συνιστούν πιο σύντομη διάρκεια DAPT και αυξημένη ιατρική παρακολούθηση.
Τέλος, είναι σημαντικό να γνωρίζει ο ασθενής ότι η DAPT δεν αντικαθιστά άλλες καρδιοπροστατευτικές θεραπείες. Η πλήρης πρόληψη περιλαμβάνει ταυτόχρονη λήψη στατίνης, έλεγχο χοληστερόλης, αρτηριακής πίεσης και σακχάρου, ώστε να μειώνεται μακροπρόθεσμα η πιθανότητα νέου εμφράγματος.
7
Τυπικές δόσεις Plavix και ασπιρίνης
Στη διπλή αντιαιμοπεταλιακή αγωγή χρησιμοποιούνται
σταθερές, χαμηλές αλλά αποτελεσματικές δόσεις,
ώστε να επιτυγχάνεται προστασία από θρόμβους
με τον μικρότερο δυνατό κίνδυνο αιμορραγίας.
- Plavix (κλοπιδογρέλη): 75 mg μία φορά την ημέρα
- Ασπιρίνη (ASA): 75–100 mg μία φορά την ημέρα
Οι δόσεις αυτές είναι επαρκείς για ισχυρή αναστολή των αιμοπεταλίων
και δεν πρέπει να τροποποιούνται χωρίς ιατρική οδηγία.
8
DAPT μετά από stent (DES / BMS)
Μετά από τοποθέτηση στεφανιαίου stent,
η DAPT είναι απολύτως κρίσιμη
για την πρόληψη της
θρόμβωσης του stent,
μιας επιπλοκής που μπορεί να προκαλέσει
αιφνίδιο έμφραγμα ή αιφνίδιο θάνατο,
ιδιαίτερα τους πρώτους μήνες.
Η απαιτούμενη διάρκεια εξαρτάται από τον τύπο του stent:
- DES (drug-eluting stent): συνήθως 6–12 μήνες DAPT, επειδή καθυστερεί η ενδοθηλιοποίηση του stent.
- BMS (bare-metal stent): τουλάχιστον 1 μήνας DAPT, καθώς επουλώνεται ταχύτερα.
Σε ασθενείς με
πολλαπλά stents, έμφραγμα, διαβήτη ή πολύπλοκη αγγειοπλαστική,
ο καρδιολόγος μπορεί να
παρατείνει τη DAPT
πέρα από τα τυπικά χρονικά όρια.
9
DAPT μετά από έμφραγμα (STEMI / NSTEMI)
Μετά από οξύ έμφραγμα μυοκαρδίου
(STEMI ή NSTEMI),
η DAPT μειώνει δραστικά τον κίνδυνο
υποτροπής εμφράγματος, θρόμβωσης stent και αιφνίδιου καρδιακού θανάτου.
Η συνιστώμενη διάρκεια είναι
τουλάχιστον 12 μήνες,
είτε έχει τοποθετηθεί stent είτε όχι,
εκτός αν υπάρχει
σοβαρός αιμορραγικός κίνδυνος.
Σε ασθενείς υψηλού ισχαιμικού κινδύνου
(π.χ. εκτεταμένο έμφραγμα, πολυαγγειακή νόσος, διαβήτης),
ο γιατρός μπορεί να εξετάσει
παράταση της DAPT
πέραν του έτους.
10
DAPT μετά από ισχαιμικό εγκεφαλικό
Σε επιλεγμένους ασθενείς με
ισχαιμικό εγκεφαλικό ή TIA,
η βραχυχρόνια DAPT μειώνει τον κίνδυνο
υποτροπής τις πρώτες εβδομάδες.
Συνήθως εφαρμόζεται για
21 έως 90 ημέρες
και στη συνέχεια συνεχίζεται μόνο
ένα αντιαιμοπεταλιακό,
καθώς η μακροχρόνια DAPT αυξάνει υπερβολικά την αιμορραγία.
11
DAPT σε περιφερική αρτηριακή νόσο (PAD)
Η περιφερική αρτηριακή νόσος (PAD) αποτελεί ένδειξη
εκτεταμένης αθηροσκλήρωσης
και συνοδεύεται από υψηλό κίνδυνο
εμφράγματος, εγκεφαλικού και ακρωτηριασμού.
Σε ασθενείς με PAD και
πρόσφατη επαναγγείωση (αγγειοπλαστική ή stent)
ή με πολλαπλά καρδιαγγειακά συμβάματα,
η DAPT μπορεί να μειώσει σημαντικά
τη θρόμβωση των αγγείων
και τις σοβαρές ισχαιμικές επιπλοκές.
Ωστόσο, επειδή οι ασθενείς με PAD έχουν συχνά
αυξημένο αιμορραγικό κίνδυνο
(ηλικία, νεφρική νόσος, αναιμία),
η απόφαση για DAPT είναι πάντα
εξατομικευμένη
και λαμβάνεται μετά από εκτίμηση
του ισχαιμικού έναντι του αιμορραγικού κινδύνου.
Σε σταθερή PAD χωρίς πρόσφατο συμβάν,
συνήθως προτιμάται
μονοθεραπεία με αντιαιμοπεταλιακό
και όχι παρατεταμένη DAPT,
εκτός αν υπάρχουν ειδικές ενδείξεις.
12
Κίνδυνοι και αιμορραγία
Ο σημαντικότερος κίνδυνος της DAPT είναι η αιμορραγία,
ιδιαίτερα από το γαστρεντερικό (στομάχι, έντερο),
τη μύτη και τα ούλα.
Σπανιότερα μπορεί να εμφανιστεί
ενδοκρανιακή αιμορραγία.
Όσο πιο ισχυρή είναι η αναστολή των αιμοπεταλίων,
τόσο μεγαλύτερος είναι ο αιμορραγικός κίνδυνος —
γι’ αυτό η διάρκεια της DAPT είναι πάντα
ισορροπία μεταξύ προστασίας από θρόμβωση και ασφάλειας.
13
Πότε και πώς διακόπτεται με ασφάλεια
Η DAPT δεν διακόπτεται ποτέ αυθαίρετα.
Η διακοπή γίνεται μόνο
κατόπιν ιατρικής οδηγίας,
όταν έχει ολοκληρωθεί η απαιτούμενη διάρκεια
ή αν προκύψει σοβαρή αιμορραγία.
Συνήθως διακόπτεται
ένα από τα δύο φάρμακα
(πιο συχνά το Plavix ή η ασπιρίνη),
ώστε να διατηρείται
κάποιο επίπεδο αντιθρομβωτικής προστασίας.
14
DAPT πριν από χειρουργείο ή οδοντίατρο
Πριν από χειρουργική ή οδοντιατρική επέμβαση
με αυξημένο αιμορραγικό κίνδυνο,
η DAPT πρέπει να
ρυθμίζεται προσεκτικά,
ώστε να μην προκληθεί επικίνδυνη αιμορραγία
αλλά ούτε και θρόμβωση του stent.
Σε γενικές γραμμές:
- Η ασπιρίνη συχνά συνεχίζεται.
- Το Plavix ή άλλο P2Y12 μπορεί να διακοπεί προσωρινά 5–7 ημέρες πριν από επεμβάσεις υψηλού κινδύνου.
Η απόφαση λαμβάνεται πάντα από
καρδιολόγο σε συνεργασία με τον χειρουργό ή οδοντίατρο,
ιδιαίτερα τους πρώτους μήνες μετά την τοποθέτηση stent,
όπου ο κίνδυνος θρόμβωσης είναι μεγαλύτερος.
15
PPIs και προστασία στομάχου
Οι αναστολείς αντλίας πρωτονίων (PPIs)
μειώνουν σημαντικά τον κίνδυνο
γαστρεντερικής αιμορραγίας
σε ασθενείς που λαμβάνουν DAPT,
ιδιαίτερα σε ηλικιωμένους,
σε ιστορικό έλκους ή σε ταυτόχρονη λήψη ΜΣΑΦ.
Συνήθως προτιμάται η
παντοπραζόλη,
καθώς έχει τη μικρότερη
φαρμακολογική αλληλεπίδραση με το Plavix
και δεν μειώνει τη δράση του.
Η προστασία στομάχου
αποτελεί βασικό μέρος της
ασφαλούς μακροχρόνιας DAPT.
16
Αλληλεπιδράσεις φαρμάκων
Ορισμένα φάρμακα μπορούν να
αυξήσουν τον κίνδυνο αιμορραγίας
ή να
μειώσουν την αντιαιμοπεταλιακή δράση του Plavix,
κάτι που μπορεί να οδηγήσει είτε σε επιπλοκές είτε σε μειωμένη προστασία από θρόμβους.
Οι πιο σημαντικές αλληλεπιδράσεις είναι:
- ΜΣΑΦ (π.χ. ιβουπροφαίνη, δικλοφενάκη, ναπροξένη) → αυξάνουν σημαντικά τον γαστρεντερικό και γενικό αιμορραγικό κίνδυνο.
- SSRIs / SNRIs (αντικαταθλιπτικά) → επηρεάζουν τη λειτουργία των αιμοπεταλίων και ενισχύουν τον κίνδυνο αιμορραγίας.
- Ορισμένοι PPIs (κυρίως ομεπραζόλη, εσομεπραζόλη) → μειώνουν την ενεργοποίηση του Plavix μέσω του CYP2C19.
Για προστασία στομάχου προτιμάται συνήθως
παντοπραζόλη,
καθώς δεν επηρεάζει κλινικά τη δράση της κλοπιδογρέλης.
Πριν προστεθεί ή διακοπεί οποιοδήποτε φάρμακο,
είναι σημαντικό να
ενημερώνεται ο θεράπων ιατρός.
17
Εναλλακτικά φάρμακα αντί Plavix
Σε ασθενείς με
ανεπαρκή ανταπόκριση, δυσανεξία ή υψηλό ισχαιμικό κίνδυνο
υπάρχουν ισχυρότεροι αναστολείς των υποδοχέων P2Y12:
- Ticagrelor (Brilique) – ταχύτερη και ισχυρότερη αναστολή αιμοπεταλίων, συχνά προτιμάται μετά από οξύ έμφραγμα.
- Prasugrel (Efient) – πολύ αποτελεσματικό σε ασθενείς με PCI, αλλά αντενδείκνυται σε ιστορικό εγκεφαλικού ή σε ηλικιωμένους με χαμηλό βάρος.
Τα φάρμακα αυτά μειώνουν περαιτέρω τον κίνδυνο θρόμβωσης,
αλλά συνοδεύονται και από
αυξημένο αιμορραγικό κίνδυνο,
γι’ αυτό η επιλογή γίνεται πάντα με βάση
την ισορροπία μεταξύ ισχαιμικού και αιμορραγικού κινδύνου
του συγκεκριμένου ασθενούς.
18
Ποιοι δεν πρέπει να παίρνουν DAPT
Η DAPT αποφεύγεται ή περιορίζεται σημαντικά σε ασθενείς με:
- Ενεργό αιμορραγία (γαστρεντερική, εγκεφαλική κ.ά.)
- Ιστορικό σοβαρής αιμορραγίας
- Σοβαρή αναιμία ή θρομβοπενία
- Πρόσφατο αιμορραγικό εγκεφαλικό
Σε αυτές τις περιπτώσεις,
η απόφαση λαμβάνεται
αυστηρά εξατομικευμένα,
σταθμίζοντας το όφελος έναντι του κινδύνου.
19
Ηλικιωμένοι και ειδικοί πληθυσμοί
Σε ηλικιωμένους >75 ετών και σε ασθενείς με
νεφρική ή ηπατική δυσλειτουργία,
ο κίνδυνος αιμορραγίας είναι αυξημένος.
Για τον λόγο αυτό,
συχνά προτιμώνται
συντομότερες διάρκειες DAPT
ή λιγότερο επιθετικά σχήματα,
με στενή ιατρική παρακολούθηση.
20
Πότε πρέπει να καλέσω γιατρό
Επικοινωνήστε άμεσα με γιατρό ή μεταβείτε σε ΤΕΠ αν εμφανιστούν:
- Έντονη ή ανεξέλεγκτη αιμορραγία
- Μαύρα κόπρανα ή αίμα στα κόπρανα
- Αίμα στα ούρα ή αιμόπτυση
- Ξαφνική αδυναμία, ζάλη ή λιποθυμία
Αυτά μπορεί να υποδηλώνουν
σοβαρή αιμορραγική επιπλοκή της DAPT
και απαιτούν άμεση εκτίμηση.
21
Συχνές ερωτήσεις για DAPT
Πόσο καιρό πρέπει να παίρνω Plavix και ασπιρίνη μαζί;
Στις περισσότερες περιπτώσεις μετά από stent ή έμφραγμα, η DAPT διαρκεί 6–12 μήνες, ανάλογα με τον τύπο του stent, το συμβάν και τον αιμορραγικό κίνδυνο.
Μπορώ να σταματήσω την ασπιρίνη και να κρατήσω μόνο το Plavix;
Ναι, σε αρκετούς ασθενείς μετά την ολοκλήρωση της DAPT συνεχίζεται ένα μόνο αντιαιμοπεταλιακό, με επιλογή που καθορίζεται από τον καρδιολόγο ανάλογα με τον κίνδυνο θρόμβωσης και αιμορραγίας.
Είναι «επικίνδυνη» η διπλή αγωγή;
Αυξάνει τον κίνδυνο αιμορραγίας, αλλά σε ασθενείς υψηλού κινδύνου μειώνει πολύ περισσότερο τον κίνδυνο θρόμβωσης stent, εμφράγματος ή εγκεφαλικού όταν εφαρμόζεται στη σωστή διάρκεια.
Χρειάζεται PPI όταν παίρνω DAPT;
Σε πολλούς ασθενείς με αυξημένο γαστρεντερικό κίνδυνο συνιστάται προστασία στομάχου με PPI, συχνά με προτίμηση στην παντοπραζόλη, σύμφωνα με ιατρική οδηγία.
Τι γίνεται αν χρειαστώ χειρουργείο ή οδοντιατρική πράξη ενώ είμαι σε DAPT;
Η αγωγή προσαρμόζεται μόνο με συνεννόηση καρδιολόγου και γιατρού της επέμβασης, ώστε να μειωθεί η αιμορραγία χωρίς να αυξηθεί ο κίνδυνος θρόμβωσης.
Τι να κάνω αν ξεχάσω μία δόση;
Πάρτε τη δόση μόλις το θυμηθείτε την ίδια ημέρα, αλλά αν πλησιάζει η επόμενη δόση, παραλείψτε τη χαμένη και συνεχίστε κανονικά χωρίς διπλή δόση.
Μπορώ να παίρνω παυσίπονα/αντιφλεγμονώδη μαζί με DAPT;
Τα ΜΣΑΦ (π.χ. ιβουπροφαίνη, ναπροξένη, δικλοφενάκη) αυξάνουν τον κίνδυνο αιμορραγίας και συνήθως αποφεύγονται· προτιμώνται εναλλακτικές μετά από ιατρική σύσταση.
Το Plavix «δεν πιάνει» σε κάποιους ανθρώπους;
Σε μικρό ποσοστό μπορεί να υπάρχει μειωμένη ανταπόκριση, και τότε ο καρδιολόγος μπορεί να αξιολογήσει αλλαγή σε άλλο P2Y12 (π.χ. ticagrelor ή prasugrel) ανάλογα με το περιστατικό.
Ποιες αιμορραγίες θεωρούνται «ανησυχητικές»;
Μαύρα κόπρανα, αίμα στα ούρα, εμετός με αίμα, αιμόπτυση, έντονη αδυναμία/ζάλη ή αιμορραγία που δεν σταματά απαιτούν άμεση ιατρική εκτίμηση.
Μπορώ να κάνω εξετάσεις αίματος όσο είμαι σε DAPT;
Ναι, μπορείτε να κάνετε τις συνήθεις εργαστηριακές εξετάσεις, αλλά είναι χρήσιμο να ενημερώνετε ότι λαμβάνετε αντιαιμοπεταλιακά, ειδικά πριν από επεμβατικές πράξεις ή παρακεντήσεις.
Τι πρέπει να έχω πάντα μαζί μου ως ασθενής σε DAPT;
Είναι χρήσιμο να έχετε σημείωση/κάρτα με τα φάρμακα και τις δόσεις σας (ασπιρίνη + P2Y12), ώστε σε επείγον περιστατικό να ενημερωθεί άμεσα το ιατρικό προσωπικό.
22
Σύνοψη για ασθενείς
σωτήριες θεραπείες μετά από stent και έμφραγμα.
Μειώνει δραστικά τον κίνδυνο
θρόμβωσης, νέου εμφράγματος και αιφνίδιου θανάτου,
αλλά απαιτεί
σωστή διάρκεια, προστασία στομάχου και ιατρική παρακολούθηση
ώστε να αποφευχθούν αιμορραγίες.
23
Ιατρική παρακολούθηση & εξετάσεις
Ερμηνεία αποτελεσμάτων από ιατρό στο εργαστήριό μας.
Μπορείτε να ελέγξετε αιματολογικές παραμέτρους, δείκτες αιμορραγίας
και να συζητήσετε την ασφάλεια της DAPT με εξειδικευμένη ιατρική καθοδήγηση.
24
Βιβλιογραφία
https://mikrobiologikolamia.gr/katalogos-eksetaseon/
https://www.nejm.org/
https://www.escardio.org/
https://www.jacc.org/
https://www.ahajournals.org/
https://www.ema.europa.eu/
Δρ. Παντελής Αναγνωστόπουλος, Ιατρός Μικροβιολόγος – Βιοπαθολόγος
Μικροβιολογικό Εργαστήριο Λαμίας, Έσλιν 19, Λαμία 35100
📞 +30-22310-66841 • Δευτέρα–Παρασκευή 07:00–13:30