PCSK9 Αναστολείς: Μηχανισμός, Κλινική Χρήση & Μείωση LDL Χοληστερόλης (Therapeutic Knowledge Hub)
Τελευταία ενημέρωση:
Η παρούσα σελίδα συνοψίζει την κλάση των PCSK9 αναστολέων (μονοκλωνικά αντισώματα και siRNA),
τον μηχανισμό δράσης, την αποτελεσματικότητα, τις κλινικές ενδείξεις και τη θέση τους στη σύγχρονη αντιμετώπιση της δυσλιπιδαιμίας και του καρδιαγγειακού κινδύνου.
Οι PCSK9 αναστολείς μπορούν να μειώσουν την LDL κατά περίπου 50–65% (ανάλογα με το σχήμα/συνδυασμούς).
Χρησιμοποιούνται κυρίως σε ASCVD και/ή οικογενή υπερχοληστερολαιμία όταν οι στόχοι LDL δεν επιτυγχάνονται με βέλτιστη θεραπεία.
1
Τι είναι οι PCSK9 αναστολείς
Οι PCSK9 αναστολείς είναι στοχευμένες υπολιπιδαιμικές θεραπείες που
παρεμβαίνουν στον κεντρικό μηχανισμό ρύθμισης των LDL υποδοχέων στο ήπαρ.
Με την αναστολή της πρωτεΐνης PCSK9,
αποτρέπουν την αποδόμηση των LDL υποδοχέων,
επιτρέποντας στο ήπαρ να απομακρύνει
πολλαπλάσια ποσότητα LDL χοληστερόλης από την κυκλοφορία.
Το αποτέλεσμα είναι μια
ισχυρή, προβλέψιμη και δοσοεξαρτώμενη μείωση της LDL.
Κλινικά, εντάσσονται στο θεραπευτικό πλάνο ασθενών που
παραμένουν πάνω από τον επιθυμητό στόχο LDL
παρά τη βέλτιστη συμβατική αγωγή
(στατίνη υψηλής έντασης ± ezetimibe),
καθώς και σε περιπτώσεις
τεκμηριωμένης δυσανεξίας στις στατίνες,
όταν απαιτείται ουσιαστική μείωση του
καρδιαγγειακού κινδύνου.
2
PCSK9 και LDL υποδοχέας: βασική φυσιολογία
Το ήπαρ ρυθμίζει τα επίπεδα της LDL χοληστερόλης μέσω των
LDL υποδοχέων στην επιφάνεια των ηπατοκυττάρων,
οι οποίοι δεσμεύουν και απομακρύνουν LDL από την κυκλοφορία.
Η πρωτεΐνη PCSK9 προσδένεται σε αυτούς τους υποδοχείς
και προάγει την ενδοκυττάρια αποδόμησή τους,
μειώνοντας τον αριθμό των λειτουργικών υποδοχέων.
Όταν η PCSK9 αναστέλλεται, οι LDL υποδοχείς
δεν καταστρέφονται αλλά
επανακυκλοφορούν στην επιφάνεια του ηπατοκυττάρου,
με αποτέλεσμα το ήπαρ να απομακρύνει
περισσότερη LDL από το αίμα.
3
Μοριακό και κλινικό πλαίσιο των PCSK9 αναστολέων
Η πρωτεΐνη PCSK9 (proprotein convertase subtilisin/kexin type 9)
αποτελεί βασικό ρυθμιστή της ομοιόστασης της LDL χοληστερόλης.
Εκκρίνεται κυρίως από το ήπαρ και προσδένεται στον
LDL υποδοχέα (LDLR) στην επιφάνεια των ηπατοκυττάρων.
Όταν το σύμπλοκο PCSK9–LDLR εσωτερικεύεται,
ο υποδοχέας κατευθύνεται προς λυσοσωμική αποδόμηση
αντί να ανακυκλωθεί στην κυτταρική επιφάνεια.
Το αποτέλεσμα είναι μια μείωση της ικανότητας κάθαρσης της LDL
και αύξηση των επιπέδων της στο πλάσμα.
Η κλινική σημασία της PCSK9 αναδείχθηκε αρχικά μέσω
γενετικών μελετών:
άτομα με loss-of-function μεταλλάξεις στο γονίδιο PCSK9
εμφανίζουν πολύ χαμηλά επίπεδα LDL και
δραστικά μειωμένο κίνδυνο εμφάνισης στεφανιαίας νόσου,
ενώ gain-of-function μεταλλάξεις
σχετίζονται με σοβαρή οικογενή υπερχοληστερολαιμία.
Αυτή η ισχυρή αιτιολογική σύνδεση καθιστά την PCSK9
ιδανικό θεραπευτικό στόχο.
Οι PCSK9 αναστολείς αξιοποιούν αυτή τη βιολογική γνώση
για να επαναφέρουν τον LDL υποδοχέα
στο φυσιολογικό του ρόλο ως «καθαριστή» της κυκλοφορίας.
Σε αντίθεση με τις στατίνες,
οι οποίες αυξάνουν τους LDL υποδοχείς
μέσω μείωσης της ενδογενούς σύνθεσης χοληστερόλης,
οι PCSK9 στρατηγικές
δεν επηρεάζουν άμεσα τον μεταβολισμό της χοληστερόλης,
αλλά δρουν στο επίπεδο της
κυτταρικής ανακύκλωσης του υποδοχέα.
Αυτό εξηγεί γιατί οι δύο κατηγορίες είναι
συμπληρωματικές και όχι ανταγωνιστικές.
Από θεραπευτική σκοπιά,
η έννοια του «υπολειπόμενου καρδιαγγειακού κινδύνου»
είναι καθοριστική.
Ακόμη και με LDL επίπεδα κοντά στους στόχους,
οι ασθενείς με καθιερωμένη ASCVD
εξακολουθούν να εμφανίζουν νέα επεισόδια,
υποδηλώνοντας ότι
το αθηρογόνο φορτίο δεν έχει εξαλειφθεί πλήρως.
Η περαιτέρω μείωση της LDL μέσω PCSK9 αναστολής
οδηγεί σε
αναλογική μείωση της συσσώρευσης λιπιδίων στο τοίχωμα των αρτηριών,
επιβραδύνοντας την εξέλιξη και
σταθεροποιώντας τις αθηρωματικές πλάκες.
Έτσι, οι PCSK9 αναστολείς δεν αποτελούν απλώς
μια «ισχυρότερη» υπολιπιδαιμική αγωγή,
αλλά μια στοχευμένη βιολογική παρέμβαση
σε έναν κεντρικό μηχανισμό της αθηροσκλήρωσης,
γεφυρώνοντας τη μοριακή παθοφυσιολογία
με τη μείωση των πραγματικών
καρδιαγγειακών συμβαμάτων.
4
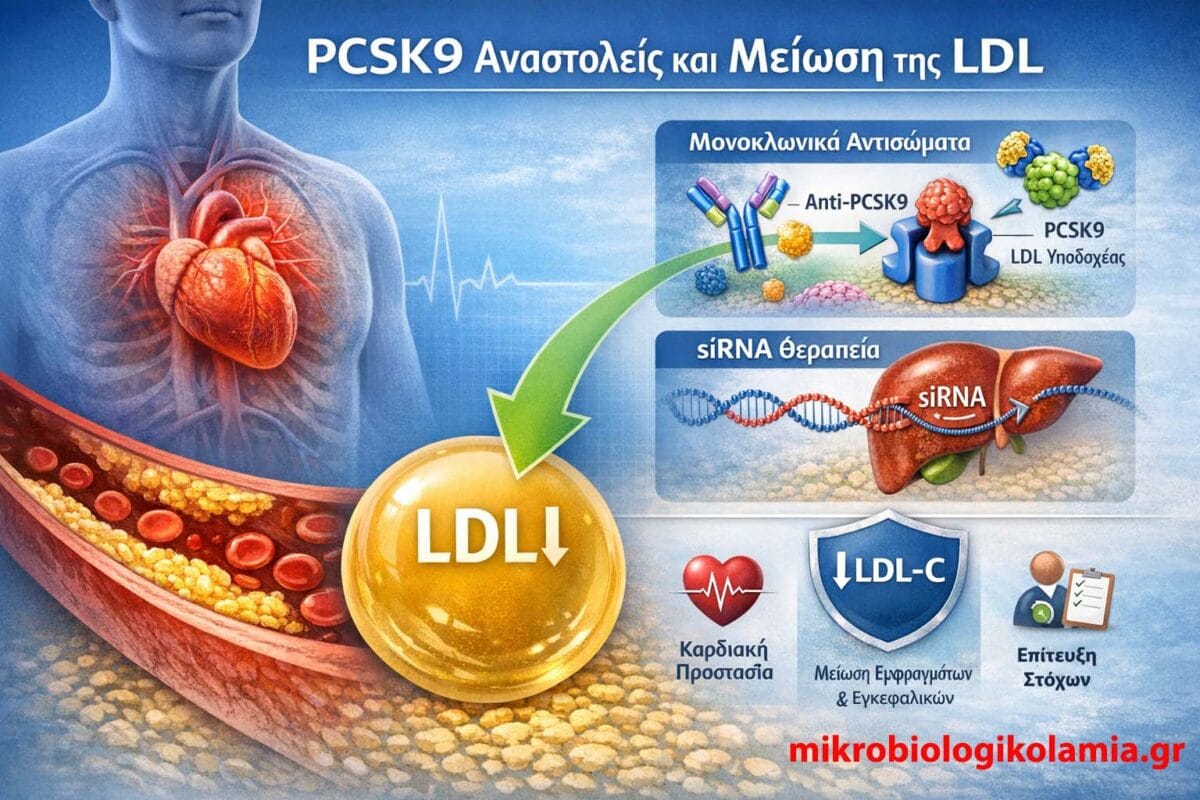
Μηχανισμός δράσης: μονοκλωνικά αντισώματα και siRNA
Ο μηχανισμός δράσης των PCSK9 στρατηγικών βασίζεται στην
αποκατάσταση της φυσιολογικής ανακύκλωσης των LDL υποδοχέων.
Φυσιολογικά, κάθε LDL υποδοχέας μπορεί να επαναχρησιμοποιηθεί πολλές φορές για να
απομακρύνει LDL από το αίμα· η PCSK9 λειτουργεί ως «σήμα καταστροφής»,
οδηγώντας τον υποδοχέα σε αποδόμηση αντί για επανακυκλοφορία.
Τα μονοκλωνικά αντισώματα (mAbs) δρουν στο εξωκυττάριο περιβάλλον,
δεσμεύοντας την PCSK9 που κυκλοφορεί στο πλάσμα και
εμποδίζοντας την προσκόλλησή της στον LDL υποδοχέα.
Με αυτόν τον τρόπο, ο υποδοχέας δεν «σηματοδοτείται» για καταστροφή και
επιστρέφει επανειλημμένα στην επιφάνεια του ηπατοκυττάρου,
αυξάνοντας τη συνολική ικανότητα κάθαρσης της LDL.
Το siRNA (inclisiran) λειτουργεί σε διαφορετικό επίπεδο:
εισέρχεται στα ηπατοκύτταρα και
αναστέλλει τη μετάφραση του mRNA της PCSK9,
μειώνοντας την ίδια την παραγωγή της πρωτεΐνης.
Το αποτέλεσμα είναι σταθερά χαμηλά επίπεδα PCSK9
για μήνες, γεγονός που εξηγεί τη μακρά διάρκεια δράσης
και τα αραιά δοσολογικά σχήματα.
αν και οι δύο τεχνολογίες στοχεύουν την ίδια βιολογική οδό,
τα mAbs προσφέρουν άμεση αναστολή της PCSK9 στο αίμα,
ενώ το siRNA προσφέρει πιο
μακρόχρονη και σταθερή καταστολή της PCSK9 από το ήπαρ.
Και οι δύο, όμως, οδηγούν σε
ισχυρή και προβλέψιμη μείωση της LDL.
5
Διαθέσιμες θεραπείες: evolocumab, alirocumab, inclisiran
Οι PCSK9 στρατηγικές βασίζονται σε δύο τεχνολογικά διαφορετικές προσεγγίσεις:
τα μονοκλωνικά αντισώματα (mAbs), που δεσμεύουν την κυκλοφορούσα PCSK9 στο αίμα,
και το siRNA, που μειώνει την παραγωγή της PCSK9 στο ήπαρ.
Και οι δύο οδηγούν σε αύξηση των λειτουργικών LDL υποδοχέων
και σε ισχυρή μείωση της LDL χοληστερόλης.
Μονοκλωνικά αντισώματα (PCSK9 inhibitors – mAbs)
- Evolocumab (Repatha®): υποδόρια χορήγηση κάθε 2 εβδομάδες ή μία φορά τον μήνα, ανάλογα με το σχήμα.
- Alirocumab (Praluent®): υποδόρια χορήγηση κάθε 2 εβδομάδες ή μηνιαία, ανάλογα με τη δόση και την ένδειξη.
siRNA έναντι PCSK9
- Inclisiran (Leqvio®): θεραπεία μακράς διάρκειας με αραιές ενέσεις εντός του έτους, παρέχοντας σταθερή και παρατεταμένη μείωση της LDL.
Τα mAbs δρουν δεσμεύοντας την PCSK9 που ήδη κυκλοφορεί στο αίμα,
ενώ το siRNA μειώνει την παραγωγή της στο ήπαρ.
Στην καθημερινή πράξη, η επιλογή επηρεάζεται κυρίως από τη
συμμόρφωση, τα κριτήρια αποζημίωσης
και τις προτιμήσεις του ασθενούς.
6
Σε ποιους ασθενείς ενδείκνυνται περισσότερο
Οι PCSK9 αναστολείς εντάσσονται στη θεραπευτική στρατηγική ασθενών με
υψηλό ή πολύ υψηλό καρδιαγγειακό κίνδυνο,
όταν η LDL χοληστερόλη παραμένει πάνω από τον εξατομικευμένο στόχο
παρά τη χρήση βέλτιστης συμβατικής αγωγής
(στατίνη υψηλής έντασης ± ezetimibe).
Στόχος δεν είναι απλώς η βελτίωση ενός βιοχημικού δείκτη,
αλλά η μείωση του πραγματικού αθηροσκληρωτικού φορτίου
και του κινδύνου για έμφραγμα, εγκεφαλικό ή αιφνίδιο καρδιακό θάνατο.
- Καθιερωμένη αθηροσκληρωτική καρδιαγγειακή νόσος (ASCVD):
ασθενείς με στεφανιαία νόσο, προηγούμενο έμφραγμα μυοκαρδίου,
αγγειακό εγκεφαλικό επεισόδιο ή περιφερική αρτηριακή νόσο
ανήκουν αυτόματα στην κατηγορία πολύ υψηλού κινδύνου
και έχουν το μεγαλύτερο απόλυτο όφελος από επιθετική μείωση της LDL. - Οικογενής υπερχοληστερολαιμία (FH):
γενετικά καθοριζόμενη διαταραχή με δια βίου έκθεση σε υψηλή LDL,
όπου οι συμβατικές θεραπείες συχνά δεν επαρκούν για την επίτευξη
ασφαλών επιπέδων χοληστερόλης. - Ανεπαρκής ανταπόκριση σε στατίνη υψηλής έντασης
με ή χωρίς ezetimibe, ιδίως όταν η LDL παραμένει
πάνω από τους στόχους των ESC/EAS σε ασθενείς πολύ υψηλού κινδύνου. - Πραγματική δυσανεξία στις στατίνες,
όπου απαιτείται εναλλακτική ισχυρή υπολιπιδαιμική στρατηγική
για την πρόληψη καρδιαγγειακών συμβαμάτων.
7
Στόχοι LDL: πώς μπαίνουν στην πράξη (ESC/EAS – κλινική λογική)
Στην καθημερινή κλινική πράξη, οι PCSK9 αναστολείς μπαίνουν στο πλάνο όταν:
ο κίνδυνος είναι πολύ υψηλός και οι στόχοι LDL δεν επιτυγχάνονται με τα “βασικά” (στατίνη ± ezetimibe).
Ο στόχος δεν είναι απλώς ένας αριθμός, αλλά η μείωση του υπολειπόμενου αθηροσκληρωτικού κινδύνου.
Όσο χαμηλότερη LDL σε υψηλό κίνδυνο, τόσο μεγαλύτερη η πιθανότητα μείωσης συμβαμάτων, ειδικά όταν η LDL παραμένει “ανθεκτικά” αυξημένη.
8
Αποτελεσματικότητα: τι έδειξαν οι μεγάλες μελέτες
Οι μεγάλες τυχαιοποιημένες μελέτες των PCSK9 στρατηγικών έδειξαν ότι η
έντονη μείωση της LDL χοληστερόλης μεταφράζεται σε
ουσιαστικό καρδιαγγειακό όφελος, ιδιαίτερα σε ασθενείς με
καθιερωμένη αθηροσκληρωτική νόσο ή
υπολειπόμενο κίνδυνο παρά τη βέλτιστη συμβατική αγωγή.
Ο παρακάτω πίνακας συνοψίζει τα βασικά ευρήματα των πιο σημαντικών κλινικών δοκιμών.
| Μελέτη | Παρέμβαση | Μείωση LDL | Κλινικό μήνυμα |
|---|---|---|---|
| FOURIER | Evolocumab | ~59% | Μείωση συμβαμάτων σε ASCVD όταν η LDL παραμένει υψηλή |
| ODYSSEY OUTCOMES | Alirocumab | ~62% | Κλινικό όφελος μετά από ACS με εντατική μείωση LDL |
| ORION-10 / ORION-11 | Inclisiran | ~50% | Ισχυρή και σταθερή LDL με αραιότερη δοσολογία (long-term outcomes σε εξέλιξη) |
9
Καρδιαγγειακά συμβάματα: τι κερδίζουμε πέρα από τη LDL
Η μείωση της LDL είναι ο κεντρικός μηχανισμός μείωσης κινδύνου. Στις μεγάλες μελέτες με mAbs παρατηρήθηκε
μείωση καρδιαγγειακών επεισοδίων σε ασθενείς υψηλού κινδύνου.
Το κλινικό όφελος είναι μεγαλύτερο όταν το “υπόστρωμα” κινδύνου είναι υψηλό (π.χ. καθιερωμένη ASCVD)
και όταν υπάρχει “χώρος” για περαιτέρω μείωση LDL.
10
Σύγκριση με στατίνες, ezetimibe και άλλες θεραπείες
Οι υπολιπιδαιμικές θεραπείες δεν είναι ισοδύναμες ως προς τη δύναμη μείωσης της LDL και το
κλινικό όφελος.
Στην καθημερινή πράξη, οι στατίνες αποτελούν τη βάση,
το ezetimibe προστίθεται όταν δεν επαρκεί,
ενώ οι PCSK9 στρατηγικές χρησιμοποιούνται όταν παραμένει
υψηλός υπολειπόμενος καρδιαγγειακός κίνδυνος
παρά τη βέλτιστη συμβατική αγωγή.
Ο παρακάτω πίνακας συνοψίζει τις βασικές διαφορές σε μηχανισμό,
αποτελεσματικότητα και πρακτικά χαρακτηριστικά.
| Χαρακτηριστικό | Στατίνες | Ezetimibe | PCSK9 στρατηγικές |
|---|---|---|---|
| Μηχανισμός | ↓ σύνθεση χοληστερόλης (HMG-CoA reductase) | ↓ εντερική απορρόφηση χοληστερόλης | ↑ LDL υποδοχείς μέσω αναστολής/μείωσης PCSK9 |
| Μείωση LDL | ~30–55% (ανάλογα ένταση) | ~15–25% | ~50–65% (συχνά επιπλέον της βασικής αγωγής) |
| Ανεπιθύμητες | μυαλγίες (σε μερίδα), ηπατικά ένζυμα (σπάνια) | συνήθως ήπιες/σπάνιες | κυρίως τοπικές αντιδράσεις στο σημείο ένεσης |
| Δοσολογία | καθημερινά (per os) | καθημερινά (per os) | υποδόρια, αραιότερα (ανάλογα σχήμα/μόριο) |
11
PCSK9 στρατηγικές και «υπολειπόμενος καρδιαγγειακός κίνδυνος»
Παρά την ευρεία χρήση των στατινών και την επιθετική μείωση της LDL χοληστερόλης,
ένα σημαντικό ποσοστό ασθενών με καθιερωμένη αθηροσκληρωτική καρδιαγγειακή νόσο (ASCVD)
συνεχίζει να εμφανίζει νέα καρδιαγγειακά συμβάματα.
Αυτό το φαινόμενο περιγράφεται ως «υπολειπόμενος καρδιαγγειακός κίνδυνος»
και αποτελεί το θεωρητικό υπόβαθρο για την ανάπτυξη των PCSK9 στρατηγικών.
Οι στατίνες μειώνουν αποτελεσματικά τη σύνθεση της χοληστερόλης και αυξάνουν τους LDL υποδοχείς,
όμως παράλληλα οδηγούν σε αύξηση της PCSK9 ως μηχανισμό ανάδρασης.
Αυτό σημαίνει ότι, όσο πιο επιθετικά μειώνεται η LDL με στατίνες,
τόσο μεγαλύτερη γίνεται η δράση της PCSK9 που περιορίζει τον αριθμό των LDL υποδοχέων.
Οι PCSK9 αναστολείς έρχονται ακριβώς να «σπάσουν» αυτό το βιολογικό φρένο,
επιτρέποντας στους LDL υποδοχείς να παραμείνουν λειτουργικοί.
Στις μεγάλες μελέτες (FOURIER και ODYSSEY OUTCOMES),
οι ασθενείς που είχαν ήδη χαμηλή LDL υπό στατίνη,
αλλά έλαβαν επιπλέον PCSK9 θεραπεία,
είδαν περαιτέρω μείωση της LDL σε επίπεδα που μέχρι πρότινος θεωρούνταν «πολύ χαμηλά».
Ωστόσο, αυτά τα πολύ χαμηλά επίπεδα συνοδεύτηκαν από
στατιστικά σημαντική μείωση εμφραγμάτων, αγγειακών εγκεφαλικών επεισοδίων
και ανάγκης για επαναιμάτωση.
Αυτό επιβεβαίωσε ότι η LDL δεν έχει «κατώφλι ασφαλείας» στο οποίο το όφελος παύει.
Η έννοια του υπολειπόμενου κινδύνου είναι ιδιαίτερα σημαντική
σε ασθενείς με οικογενή υπερχοληστερολαιμία,
σε άτομα με πολλαπλά προηγούμενα καρδιαγγειακά επεισόδια
και σε όσους έχουν συνυπάρχοντα παράγοντα κινδύνου
όπως ο σακχαρώδης διαβήτης ή αυξημένη Lp(a).
Σε αυτές τις ομάδες, ακόμα και LDL τιμές κοντά στους «στόχους»
μπορεί να μην είναι αρκετές για να μειώσουν τον πραγματικό κίνδυνο.
Οι PCSK9 στρατηγικές δεν αντικαθιστούν τις στατίνες,
αλλά εντάσσονται σε μια πολυεπίπεδη προσέγγιση με στόχο
τη μέγιστη δυνατή μείωση της αθηρογόνου επιβάρυνσης.
Με αυτόν τον τρόπο, μετατρέπουν τη βιοχημική επίτευξη χαμηλής LDL
σε πραγματική μείωση καρδιαγγειακών συμβαμάτων,
που είναι και το τελικό ζητούμενο της θεραπείας.
12
Ασφάλεια και ανεπιθύμητες ενέργειες
Συνολικά, οι PCSK9 στρατηγικές εμφανίζουν
πολύ καλό προφίλ ασφάλειας στις μεγάλες κλινικές μελέτες και στην κλινική πράξη.
Οι περισσότερες ανεπιθύμητες ενέργειες είναι ήπιες
και σχετίζονται κυρίως με την υποδόρια χορήγηση και όχι με συστηματική τοξικότητα.
- Ήπιος ερεθισμός, ερυθρότητα ή πόνος στο σημείο της ένεσης
- Συμπτώματα τύπου “κρυολογήματος” ή ρινοφαρυγγίτιδα σε μερίδα ασθενών
- Σπάνιες αντιδράσεις υπερευαισθησίας
Σε αντίθεση με τις στατίνες, οι PCSK9 στρατηγικές
δεν σχετίζονται με ηπατοτοξικότητα ή μυοπάθεια.
Στην πράξη, η παρακολούθηση επικεντρώνεται στη
μέτρηση της LDL χοληστερόλης και στην επιβεβαίωση ότι επιτυγχάνονται και διατηρούνται οι θεραπευτικοί στόχοι.
13
Ειδικές ομάδες: ηλικιωμένοι, διαβήτης, νεφρική & ηπατική νόσος
Οι PCSK9 αναστολείς έχουν μελετηθεί σε πολλές κατηγορίες ασθενών
και μπορούν να χρησιμοποιηθούν με ασφάλεια όταν ο
καρδιαγγειακός κίνδυνος είναι υψηλός
και απαιτείται ισχυρή μείωση της LDL χοληστερόλης.
- Ηλικιωμένοι: συχνά έχουν τον μεγαλύτερο απόλυτο κίνδυνο για έμφραγμα ή εγκεφαλικό, άρα μπορούν να ωφεληθούν ιδιαίτερα από επιθετική μείωση της LDL.
- Σακχαρώδης διαβήτης: οι PCSK9 στρατηγικές δεν επηρεάζουν το σάκχαρο και είναι κατάλληλες σε διαβητικούς υψηλού κινδύνου.
- Νεφρική ή ηπατική νόσος: μπορούν να χρησιμοποιηθούν, καθώς δεν βασίζονται στον μεταβολισμό του ήπατος όπως οι στατίνες· η απόφαση όμως λαμβάνει πάντα υπόψη το συνολικό ιατρικό προφίλ.
14
Επίδραση στην Lp(a): τι γνωρίζουμε
Η λιποπρωτεΐνη(a) αποτελεί έναν
ανεξάρτητο και γενετικά καθοριζόμενο παράγοντα καρδιαγγειακού κινδύνου
που ανταποκρίνεται ελάχιστα στις στατίνες και στο ezetimibe.
Τα μονοκλωνικά αντισώματα κατά της PCSK9 έχουν δείξει
μέτρια αλλά αναπαραγώγιμη μείωση της Lp(a),
συνήθως της τάξης του 20–30%.
Παρότι αυτή η μείωση είναι κλινικά ενδιαφέρουσα,
η κύρια θεραπευτική ένδειξη των PCSK9 αναστολέων
παραμένει η δραστική μείωση της LDL χοληστερόλης
και η αντίστοιχη μείωση του καρδιαγγειακού κινδύνου
σε ασθενείς υψηλού κινδύνου.
15
Πρακτικά θέματα: χορήγηση, παρακολούθηση, συμμόρφωση
Στην καθημερινή κλινική πράξη, η ένταξη ενός
PCSK9 αναστολέα ακολουθεί ένα σαφές και τεκμηριωμένο θεραπευτικό μονοπάτι:
εκτίμηση καρδιαγγειακού κινδύνου →
μέγιστη ανεκτή βασική αγωγή (στατίνη ± ezetimibe) →
επανέλεγχος LDL →
προσθήκη PCSK9 στρατηγικής όταν ο
υπολειπόμενος αθηροσκληρωτικός κίνδυνος
παραμένει υψηλός.
Ο στόχος δεν είναι απλώς η επίτευξη ενός αριθμού,
αλλά η σταθερή διατήρηση της LDL σε επίπεδα που μειώνουν
τον κίνδυνο εμφράγματος και εγκεφαλικού.
- Παρακολούθηση:
απαιτείται τακτικός επανέλεγχος του λιπιδαιμικού προφίλ,
ώστε να τεκμηριώνεται η επίτευξη και η διατήρηση των θεραπευτικών στόχων LDL. - Συμμόρφωση:
τα μακρά δοσολογικά διαστήματα (ιδίως με inclisiran)
μειώνουν την πιθανότητα παράλειψης δόσεων
και βελτιώνουν τη μακροχρόνια θεραπευτική προσκόλληση. - Συνδυασμοί:
όταν είναι ανεκτά, οι PCSK9 αναστολείς χρησιμοποιούνται
συμπληρωματικά με στατίνες και/ή ezetimibe,
ώστε να επιτυγχάνεται η μέγιστη δυνατή μείωση της LDL
και του συνολικού καρδιαγγειακού κινδύνου.
16
Συχνά κλινικά λάθη και παγίδες ερμηνείας
να ξεκινά PCSK9 θεραπεία χωρίς να έχει πρώτα δοκιμαστεί σωστά η βασική αγωγή
(στατίνη ± ezetimibe) ή χωρίς να υπάρχει σαφής ένδειξη υψηλού καρδιαγγειακού κινδύνου.
- Υποεκτίμηση κινδύνου: ασθενείς με προηγούμενο έμφραγμα ή εγκεφαλικό θεωρούνται πάντα πολύ υψηλού κινδύνου.
- Απουσία επανελέγχου LDL: χωρίς νέα εξέταση δεν ξέρουμε αν η θεραπεία πέτυχε τον στόχο.
- Εστίαση μόνο στον αριθμό: η LDL είναι εργαλείο για να μειωθεί ο πραγματικός κίνδυνος καρδιαγγειακών επεισοδίων.
Οι PCSK9 αναστολείς δεν είναι «εναλλακτική» των στατινών,
αλλά στρατηγική για τη μείωση του υπολειπόμενου καρδιαγγειακού κινδύνου
όταν η LDL παραμένει πάνω από τον στόχο.
Η σωστή ένδειξη, η επιβεβαίωση των τιμών LDL και η παρακολούθηση
είναι αυτά που καθορίζουν το πραγματικό όφελος για τον ασθενή.
17
Συχνές Ερωτήσεις (FAQ)
Τι είναι οι PCSK9 αναστολείς;
Είναι θεραπείες που στοχεύουν την PCSK9 ώστε να αυξάνουν τους LDL υποδοχείς στο ήπαρ και να μειώνουν δραστικά την LDL χοληστερόλη.
Πόσο μειώνουν την LDL;
Συχνά μειώνουν την LDL κατά περίπου 50–65%, ανάλογα με το μόριο, το σχήμα και τους συνδυασμούς με άλλη αγωγή.
Ποια είναι η διαφορά mAbs και inclisiran;
Τα mAbs δεσμεύουν την κυκλοφορούσα PCSK9, ενώ το inclisiran μειώνει την παραγωγή PCSK9 στο ήπαρ (siRNA), με πιο αραιά σχήματα δόσεων.
Σε ποιους ασθενείς χρησιμοποιούνται συχνότερα;
Κυρίως σε ASCVD και/ή οικογενή υπερχοληστερολαιμία, όταν οι στόχοι LDL δεν επιτυγχάνονται με βέλτιστη αγωγή ή υπάρχει δυσανεξία σε στατίνες.
Είναι ασφαλείς;
Στις μεγάλες μελέτες έχουν δείξει καλό προφίλ ασφάλειας, με συχνότερες ήπιες αντιδράσεις στο σημείο της ένεσης.
Μειώνουν την Lp(a);
Τα mAbs κατά της PCSK9 έχουν δείξει μέτρια μείωση της Lp(a) (συχνά ~20–30%), αλλά ο κύριος στόχος παραμένει η LDL.
Πόσο γρήγορα αρχίζουν να δρουν οι PCSK9 αναστολείς;
Σημαντική μείωση της LDL παρατηρείται συνήθως μέσα στις πρώτες 2–4 εβδομάδες από την έναρξη.
Πρέπει να συνεχίζονται οι στατίνες μαζί με PCSK9 αναστολέα;
Ναι, όταν είναι ανεκτές, οι στατίνες συνδυάζονται με PCSK9 στρατηγικές για μέγιστη μείωση LDL και κινδύνου.
Χρειάζεται παρακολούθηση ήπατος όπως με τις στατίνες;
Όχι, οι PCSK9 στρατηγικές δεν σχετίζονται με ηπατοτοξικότητα όπως οι στατίνες.
Μπορούν να χρησιμοποιηθούν σε διαβητικούς ασθενείς;
Ναι, έχουν δείξει καλή ασφάλεια και αποτελεσματικότητα σε ασθενείς με σακχαρώδη διαβήτη τύπου 2.
Είναι κατάλληλοι για ηλικιωμένους;
Ναι, μπορούν να χρησιμοποιηθούν και σε άτομα άνω των 65 ετών όταν υπάρχει υψηλός καρδιαγγειακός κίνδυνος.
Πόσο μειώνουν τον καρδιαγγειακό κίνδυνο;
Στις μεγάλες μελέτες παρατηρήθηκε μείωση καρδιαγγειακών επεισοδίων περίπου 15–20% σε ασθενείς υψηλού κινδύνου.
Ποιοι ασθενείς έχουν το μεγαλύτερο όφελος;
Εκείνοι με καθιερωμένη ASCVD ή οικογενή υπερχοληστερολαιμία που παραμένουν πάνω από τον στόχο LDL παρά βέλτιστη αγωγή.
Μπορούν να χρησιμοποιηθούν χωρίς στατίνες;
Ναι, σε περιπτώσεις πραγματικής δυσανεξίας στις στατίνες μπορούν να χορηγηθούν ως εναλλακτική στρατηγική.
18
Ερμηνεία αποτελεσμάτων & εξετάσεις λιπιδίων
Ερμηνεία αποτελεσμάτων από ιατρό στο εργαστήριό μας.
Αν έχετε πρόσφατες τιμές LDL χοληστερόλης, Lp(a), ApoB ή λιπιδαιμικό προφίλ,
μπορούμε να τις αξιολογήσουμε κλινικά και να σας καθοδηγήσουμε για τα επόμενα βήματα.
19
Βιβλιογραφία
https://doi.org/10.1056/NEJMoa1615664
https://doi.org/10.1056/NEJMoa1801174
https://doi.org/10.1056/NEJMoa1913805
https://doi.org/10.1016/j.jacc.2020.11.065
https://doi.org/10.1093/eurheartj/ehz455
https://doi.org/10.1038/s41569-021-00595-2
https://mikrobiologikolamia.gr/katalogos-eksetaseon/
Δρ. Παντελής Αναγνωστόπουλος, Ιατρός Μικροβιολόγος – Βιοπαθολόγος
Μικροβιολογικό Εργαστήριο Λαμίας, Έσλιν 19, Λαμία 35100
📞 +30-22310-66841 • Δευτέρα–Παρασκευή 07:00–13:30